נחשפה פעילות חלבונים האחראים על התהליכים שבהם נעזרים הצמחים כדי להתמודד עם תנאי יובש


מחקר
נחשפה פעילות חלבונים האחראים על התהליכים שבהם נעזרים הצמחים כדי להתמודד עם תנאי יובש

מסתבר שלא רק האנושות חייבת לעשות שינויים מהירים כדי להתמודד עם משבר האקלים. גם צמחים, שעד כה גדלו בסביבה עשירה במים, נאלצים להתמודד עם מצבי קיצון, שמתאפיינים במחסור חמור במים ובלחות. איך הם עושים את זה? חוקרים באוניברסיטת תל אביב חשפו מנגנון מרכזי בצמחים, שמסייע להם להתמודד עם תנאי יובש. מדובר בחלבונים המניעים ומווסתים מולקולת סיגנל קטנה, שמבקרת שני תהליכים חיוניים: סגירת הפיוניות בעלים כדי למנוע אובדן מים וצמיחת מערך מסועף של שורשים צדדיים שקולטים מים מהאדמה. לדברי החוקרים, הבנת מנגנוני התגובה של צמחים לסביבה המשתנה עשוי לתרום תרומה משמעותית לחקלאות בעידן של שינויי אקלים, ובכך לשפר את ביטחון המזון בעולם.
את המחקר הבינלאומי, שנמשך 6 שנים וכלל שלבים רבים, הובילו ד"ר יוצין ג'אנג ופרופ' אילון שני מבית הספר למדעי הצמח ואבטחת מזון בפקולטה למדעי החיים ע"ש ג'ורג' ס' וייז, והשתתפו בו חוקרים ממכון ויצמן, משווייץ, מגרמניה, מארה"ב ומדנמרק.
"ההבנה של תגובת הצמחים לסביבתם המשתנה חשובה מאוד בעידן של שינויי אקלים מהירים, ויש לה משמעות רבה עבור גידולים חקלאיים המזינים את האנושות", אומר פרופ' שני. "כבר זמן רב ידוע כי אחת מתגובות הצמח למחסור במים היא סגירת הפיוניות – פתחים קטנים בעלים שמאפשרים מגע עם הסביבה. כשהפיוניות פתוחות גוברת הכניסה והיציאה של גזים, תהליך הפוטוסינתזה מואץ, והצמח מייצר אנרגיה, גדל ומניב פירות. אך כשהצמח מבקש לשמור על מעט המים העומדים לרשותו, הוא סוגר את הפיוניות ומקטין את תהליך אידוי המים דרך העלים. מדובר במנגנון רגיש ומהיר במיוחד, שבאמצעותו שומר הצמח על האיזון הנכון בכל רגע: הוא פותח או סוגר פיוניות תוך שניות עד דקות בתגובה לכל שינוי קטן בזמינות המים, בטמפרטורה, ובכמות האור".
לדברי החוקרים, כבר בשנות ה-60 של המאה הקודמת התברר כי אחד החומרים העיקריים במנגנון השליטה בפיוניות הוא הורמון צמחי הקרוי ABA - מולקולת סיגנל קטנה שמאותתת לפיוניות כי עליהן להיסגר. בנוכחות רמה גבוהה של ABA הפיוניות נסגרות, ולהפך: בהיעדרו הן נפתחות.
הסברה הרווחת במשך שנים הייתה שה-ABA נוצר בשורשים בתגובה ליובש באדמה, ואז מטפס במעלה הגבעול אל העלים כדי לסגור את הפיוניות. במחקר הנוכחי בחנו החוקרים את ההשערה הזאת, ומצאו כי המציאות מורכבת הרבה יותר. המאמר פורסם בכתב העת Science Advances.
"לצורך המחקר נעזרנו בצמח המודל ארבידופסיס (תודרנית לבנה), והשתמשנו במגוון רחב של טכניקות מתקדמות מתחום הגנטיקה המולקולרית: יצירת מוטציות בעריכה גנטית, הפעלה והשתקה של גנים המעורבים בתהליך בתאים ספציפיים, אפיונים פיזיולוגיים עם מכשור מתקדם ואף מבחני הובלה של ABA בביציות של צפרדעים. כמו כן נעזרנו בשילוב של מיקרוסקופים משוכללים עם שיטות כימיות וגנטיות שונות לסימון פלואורסנטי כדי לאתר בצמח את מיקומם המדויק של מולקולת ABA והחלבונים המעורבים", מסביר פרופ' שני.
הממצאים הפתיעו את החוקרים. הם גילו כי מולקולת הסיגנל ABA נאגרת במצב 'רדום' בעלים עצמם, בתאים הקרויים תאי מזופיל, שממלאים תפקיד מרכזי בתהליך הפוטוסינתזה. אגירה זו מתבצעת באופן אקטיבי על ידי שני חלבונים נשאים (טרנספורטרים), שלא היו מוכרים עד כה, ABCG17 ו-ABCG18, האחראים על העברת ה-ABA שמחוץ לתא, דרך ממברנת התא, אל תוך תאי המזופיל. כאן עובר ה-ABA למצב לא פעיל על ידי קשירה למולקולת סוכר, ונאגר לאורך זמן.
כדי לבחון את תפקידם של שני החלבונים החדשים יצרו החוקרים מוטציות שונות בגנים שמייצרים אותם, וביצעו מגוון ניסויים נוספים שהשפיעו על פעילות החלבונים בזמן ובמרחב. הם מצאו כי שינויים בייצור החלבונים ובפעילותם גורמים לתנודות בהעברת ובאגירת מולקולות ה-ABA בצמח, וכי בהיעדר החלבונים נותר ה-ABA חופשי, מגיע בריכוזים גבוהים לפיוניות ומעודד את סגירתן. לדברי החוקרים, מנגנון זה מאפשר לצמחים להגיב במהירות לתנאי הסביבה המשתנים. באופן ספציפי, כאשר הצמח חש עקת יובש יורדות הכמות והפעילות של שני החלבונים, ה-ABA 'מתעורר מתרדמתו', והפיוניות נסגרות בתוך זמן קצר.
עוד מצאו החוקרים כי התנועה ארוכת הטווח של הורמון ה-ABA בצמח הפוכה מכפי שסברו עד כה: באמצעות מערכת צרורות ההובלה, המקבילה למערכת הדם שלנו, נע ה-ABA מרחק גדול - דווקא מהעלים לשורשים, ולא להפך. תנועה זו מבוקרת אף היא על ידי אותם חלבונים נשאים, ABCG17 ו-ABCG18: ירידה בפעילותם של שני החלבונים בעלה גורמת לירידה באגירת ABA בתאי המזופיל במצב 'רדום', וה-ABA החופשי נע בכיוון השורש. הצטברות ABA בשורש מבקרת התפתחות של שורשים צדדיים, שקולטים עוד מים מהאדמה.
"במחקר זה הוספנו נדבך חשוב להבנת המנגנון שבאמצעותו מתמודד הצמח עם תנאים משתנים כמו מחסור במים. לראשונה גילינו מנגנון בקרה שבאמצעותו אוגר הצמח מולקולות סיגנל ב'מחסן', ומשחרר אותן בתנאים הרצויים. תגלית זו עשויה לתרום תרומה משמעותית לחקלאות בעידן של שינויי אקלים מהירים, ובכך לשפר את ביטחון המזון בעולם. במחקרי המשך אנו בוחנים כעת מנגנונים דומים בשני גידולים חקלאיים חשובים: עגבנייה ואורז", מסכם פרופ' שני.

מחקר
מחקר שנערך על צרצרים מגלה כי זיהום האור מוציא אותם מסנכרון, פוגע ביכולת הרבייה שלהן ומאיים על המשך קיומם

מי שמטייל בשעות הערב בחוץ בוודאי שמע לא פעם מסבך השיחים או מחלקת הדשא הקרובה את קולות הצרצור שמשמיע הצרצר הזכר לנקבות, כדי שיבואו ולהזדווג אתו. אם תהיתם למה לפעמים הצרצר שוכח "לכבות את המתג" ולהמשיך לעשות זאת גם בשעות היום - יש לכך הסבר. מחקר משותף של אוניברסיטת תל אביב והאוניברסיטה הפתוחה גילה כי חשיפת צרצרים זכרים לתאורה בשעות החשיכה עלולה לשבש את מחזור הפעילות שלהם. לדברי החוקרים, השיבוש עלול לפגוע ברבייה ואף לסכן את קיומו של המין כולו.
המחקר נערך בהובלת פרופ' אמיר אילי וקרן לוי מבית הספר לזואולוגיה בפקולטה למדעי החיים ע"ש ג'ורג' ס' וייז ומוזיאון הטבע ע"ש שטיינהרדט, ופרופ' ענת ברנע מהמחלקה למדעי הטבע והחיים באוניברסיטה הפתוחה. כמו כן במחקר השתתפו במחקר יואב ויגרצין ממעבדתו של פרופ' אילי ורוני עפרוני מאוניברסיטת תל אביב.
"בפרק א' של ספר בראשית כתוב: ' וַיֹּאמֶר אֱלֹהִים, יְהִי אוֹר; וַיְהִי-אוֹר... וַיַּבְדֵּל אֱלֹהִים, בֵּין הָאוֹר וּבֵין הַחֹשֶׁךְ. וַיִּקְרָא אֱלֹהִים לָאוֹר יוֹם, וְלַחֹשֶׁךְ קָרָא לָיְלָה...'. ואכן, ההבחנה בין יום ללילה, בין אור לחושך, היא אחד מיסודות החיים על פני כדור הארץ. אך האדם, שהוא חיית יום בדרך כלל, משבש את הסדר הטבעי: הוא מייצר תאורת לילה מלאכותית, שמגרשת את החושך ומאפשרת לו להמשיך בפעילות גם בלילה. נכון להיום, יותר מ-80% מבני האדם חיים תחת זיהום אור, והיקף התאורה המלאכותית בלילה עולה בכ-5% מדי שנה", מסבירה קרן לוי.
"לצערנו, לעתים קרובות התאורה הזאת משפיעה לרעה על הסביבה, ומשבשת התנהגויות טבעיות שהתפתחו לאורך מיליוני שנות אבולוציה. מחזורי השינה של יצורים רבים משתבשים, תוחלת החיים שלהם מתקצרת, והפעילות של בעלי חיים ליליים נפגעת. כך לדוגמה חיפושית הזבל שמנווטת על פי שביל החלב ברקיע, מאבדת את דרכה כשזיהום האור גובר, צבי ים הבוקעים מהביצה בחוף עושים דרכם אל המקום הבהיר ביותר בסביבה (שאמור להיות הים), ומגיעים לטיילת הסמוכה ועוד ועוד", היא מוסיפה.
במחקר הנוכחי בחנו החוקרים את השפעת זיהום האור על צרצר השדה, חרק לילי שצרצורו נשמע היטב בעונה זו ברחבי הארץ, כאשר זכרים בוגרים קוראים לנקבות לבוא ולהזדווג עמם. במסגרת המחקר החוקרים עקבו אחרי עשרות צרצרים משלב הביצה ועד בגרות בארבע קבוצות שנחשפו לתנאי תאורה שונים.
החוקרים מצאו שצרצרים שחוו 12 שעות חשיכה ו-12 שעות אור התנהגו בצורה מחזורית מסודרת: 87% מהם החלו לצרצר עם כיבוי האור, וכשעלה 'הבוקר' חדלו לצרצר ו-100% מהם החלו בפעילות יומית רגילה. לעומתם, צרצרים שחוו תאורה חלקית בשעות החשיכה, איבדו את הסנכרון הטבעי: 80% מהם פיתחו מקצב פנימי פרטי משלהם ו-5% איבדו את המקצב לגמרי. לבסוף, אף אחד מהצרצרים שחיו באור 24/7 לא פיתח מקצב טבעי של פעילות: 71% מהם פיתחו מחזור פנימי משובש, ו-29% איבדו לחלוטין את המקצב וצרצרו ו/או שוטטו לסירוגין ללא כל סדר וארגון. בנוסף, הסנכרון בין שתי ההתנהגויות, הצרצור והתנועה, של כל פרט בפני עצמו, השתבש אף הוא. רמת הסנכרון של הצרצור עם הסביבה נפלה מיידית, בעוד שסנכרון התנועה עם תנאי הסביבה ירד באופן הדרגתי. המאמר פורסם בכתב העת-Proceedings of the Royal Society: B וזכה לאזכור גם ב-Nature.

כבו את האור ותנו לצרצר לחיות
"בטבע יש לצרצרים מחזור פעילות קבוע ומסודר. התנהגות של צרצור, כלומר תקשורת עם נקבות, מתקיימת במשך הלילה ונפסקת בשעות היום. אנחנו חשפנו את הצרצרים לתנאים מגוונים של תאורה וחשיכה, ובדקנו את ההשפעה על שתי התנהגויות - צרצור ותנועה בשטח. עבור כל צרצר וכל התנהגות חישבנו את מקצבי הפעילות", מסביר פרופ' אילי.
"המחקר שלנו הראה כי צרצרים שמחזור האור והחושך שלהם מופר מתנהגים כמו בני נוער בחופשה: פעילים או ישנים על פי שעון פנימי משלהם, או ללא כל סדר. למעשה, בהשפעת זיהום האור שיוצר האדם, מאבדים הצרצרים את הקשר שלהם לסביבה הטבעית. שיבוש זמני הצרצור, שמהווה תקשורת בין הזכר לנקבה לצורך רבייה, עלול במצבים קיצוניים לסכן את קיומה של האוכלוסייה ואפילו של המין כולו", אומרת קרן לוי בדאגה ומסכמת "הממצאים שלנו מתווספים למחקרים רבים מכל העולם שמוכיחים את הנזק החמור שגורם זיהום האור לבעלי החיים ולצמחים בטבע. אנו קוראים לכל אחת ואחד מכם להתחשב בסביבה, לכבות או לפחות להחליש אורות שאינם חיוניים ברחוב, בעבודה, ברכב, בבית ובגינה הפרטית, ולאפשר דו-קיום לילי עם היצורים שחיים סביבנו."

מחקר
מעקב אחר מאות ציפורים באמצעות GPS שופך אור על תהליכים טבעיים ומאפשר התערבות חכמה לטובת האקולוגיה

ציפורים הן בעלי חיים מרתקים, שיכולים לספק לנו מידע רב אודות הטבע והסביבה והשינויים שחלים בו. אבל הן גם ביישניות מאוד, וכל חוקר ציפורים מנוסה יודע שתצפיות בשטח מספקות מידע חלקי בלבד. איך אפשר להתגבר על המשימה המורכבת? בפרויקט ייחודי מסוגו שמתקיים בישראל, בהובלת ד"ר אור שפיגל מבית הספר לזואולוגיה בפקולטה למדעי החיים ע"ש ג'ורג' ס' וייז, ופרופ' אסף שוורץ מהטכניון, עוקבים החוקרים במקביל אחר מאות עופות ממינים שונים באמצעות GPS - התקן מעקב זעיר שמוצמד לגב העוף. מערכת המעקב החדשה, ATLAS, שמותקנת בעמק חרוד ועמק המעיינות, מספקת לחוקרים כמות עצומה של נתונים, שאותם הם מנתחים בעזרת טכנולוגיות בינה מלאכותית, בלמידת מכונה ובשיטות חדישות של ביג דאטה. ומה הם גילו עד כה? שבולבולים לא אוהבים לעוף בשדות, שיש שחרורים שחומקים בלילות לממלכת ירדן, שאפשר לעזור לחקלאות במזרח התיכון ואפילו לקרב בין עמים בזכות עידוד התרבות התנשמות ויש עוד כמה סודות שייחשפו בהמשך.
מערכת אטלס היא פיתוח ייחודי של פרופ' סיון טולדו מבית הספר למדעי המחשב ע"ש בלווטניק, ושל פרופ' רן נתן מהאוניברסיטה העברית וראש מרכז מינרווה לחקר התנועה. המערכת עובדת על ידי הצמדת משדר זעיר לגב העוף. אורך החיים של סוללת המשדר נע בין שבועיים למינים הקטנים ועד יותר משנה למינים גדולים כמו תנשמת. אחד היתרונות הטכנולוגיים החשובים של מערכת אטלס היא האפשרות להצמיד משדרים קטנים וזולים במיוחד לעופות ובעלי חיים אחרים.
"המערכת החדשנית מאפשרת למעשה לעקוב אחר בעלי חיים קטנים ברזולוציות חסרות תקדים. פתאום רואים את הפרטים, זה כמו להרכיב משקפיים בפעם הראשונה", מספר בהתרגשות ד"ר שפיגל. "זו חוויה אדירה, אנחנו עוקבים במקביל אחר מינים מגוונים כמו תנשמות, סיקסקים, בזים, נקרים, בולבולים, עורבנים, שלדגים ועוד". המחקר הוצג לאחרונה במסגרת הכנס הראשון של יוזמת AI4Good המשותפת לאוניברסיטת תל אביב ולגוגל, שהוקדש לתרומה האפשרית של בינה מלאכותית לחקר ולשימור הסביבה.
לדבריו של ד"ר שפיגל, ככלל, ניתן להצמיד משדר של עד 4% ממשקל הציפור, כדי שלא להכביד על מעופה. כלומר, אם הציפור שוקלת 100 גרם – המשדר שלה שוקל ארבעה גרם בלבד. "היתרון של ה-GPS הוא אדיר. אם פעם היה אפשר להוציא מעט נקודות למשדר של ארבעה גרם - במערכת GPS אפשר להוציא מאות נקודות, ומערכת אטלס מאפשרת לנו להוציא מאות אלפי נקודות תנועה ממשדר של ארבעה גרם. כמובן שמאות אלפי נקודות כפול 150 פרטים זה המון מידע מאוד רלוונטי", הוא אומר.
במערכת אטלס משתמשים מדעניות ומדענים רבים, החוקרים היבטים זואולוגיים ואקולוגיים שונים כדי לאפיין את המסדרון האקולוגי של עמק חרוד. "המסדרון האקולוגי מאפשר לאוכלוסייה לשמור על רציפות, אחרת תהיינה שתי אוכלוסיות המופרדות זו מזו על ידי מחסומים כגון ישובים ותשתיות, והן יהיו פגיעות יותר להכחדה", מסביר ד"ר שפיגל. "עד כה השתמשו במצלמות כדי לראות אם הצבי למשל משתמש במסדרון או לא. מערכת אטלס מעניקה לנו רזולוציה גבוהה הרבה יותר. אנחנו מניחים שכל בעלי החיים יכולים לעבור דרך המסדרון, אבל הנה לדוגמא, גילינו עכשיו שבולבולים נמנעים משדות. ברמת התכנון הנופי, צריך רק להוסיף שישה מטרים של צמחייה טבעית בשולי השדות, וכך נאפשר גם לציפורים כמו הבולבול להשתמש בפרוזדור ביעילות, מבלי לחצות את השדות. הטבע ירוויח והחקלאי לא יפסיד הרבה שטח ויקבל פיצוי מהרשויות. כל ציפור והדרישות שלה".

לא אוהב לעבור בשדות. בולבול צהוב שת
אחד הפרויקטים המעניינים ביותר שמשתמשים במערכת אטלס הוא פרויקט התנשמות של הדוקטורנט שלמה קאין, בהנחיית ד"ר שפיגל ופרופ' אמירטוס יוסי לשם, מהמחלקה לזואולוגיה באוניברסיטת תל אביב ומייסד המרכז הבינלאומי לחקר נדידות הציפורים. תנשמת היא ציפור גדולה יחסית, במשקל כ-400 גרם, שניזונה בעיקר מנברנים (מין עכבר המזיק לשדות חקלאיים), וממכרסמים אחרים. הרעיון מאחורי הפרויקט הוא לעודד את שגשוג אוכלוסיית התנשמות כתחליף טבעי לחומרי הדברה כימיים שנועדו להרחיק נברנים, שעולים לחקלאים הרבה מאוד כסף ושבסופו של דבר מחלחלים גם לקרקע ולמי השתייה של כולנו, ופוגעים בחיות הבר, בציפורים נודדות ובאדם.
"החל משנת 2002 אנחנו עובדים עם חקלאים פלסטינים וירדנים בפרויקט שנקרא 'ציפורים לא יודעות גבולות', וב-2008 הפרויקט הפך לפרויקט לאומי", אומר פרופ' לשם. "כל תנשמת מגדלת בין 5 ל-12 גוזלים, אבל לשם כך היא צריכה תיבת קינון. אנחנו מספקים לה את התנאים לקנן בשטחים חקלאיים באמצעות הנחת תיבה המתאימה לתנשמת, ובאמת איפה שיש תיבה כזאת החקלאים מפסיקים להשתמש בחומרי הדברה. מערכת אטלס מספקת לנו מידע על תנועת התנשמות, כדי שנדע איפה להניח את התיבות, ובינתיים יש לנו כ-5,000 תיבות בישראל, ברשות הפלסטינית ובירדן. התנשמות האלה מחברות בין העמים, בין מוסלמים ליהודים, כי הן באמת לא יודעות גבולות, ומתוך כ-70 תנשמות שמשדרות - 7 כבר עפו לירדן".
שלא כמו התנשמת, שידוע כי היא מגיעה למרחקים ארוכים, מחוץ לעונת הנדידה שלהן ציפורי שיר משוטטות על פני מרחב מצומצם בהרבה. חידוש מפתיע ומרגש הגיע במסגרת פרויקט של הדוקטורנטית מיכל הנדל, בשיתוף פעולה של אוניברסיטת תל אביב והטכניון והצפר יוחאי וסרלאוף. בתחילת חודש יוני השנה הם הצמידו משדר לציפור שיר ממין שחרור. אחרי מספר שבועות בהן שהה השחרור שהה בפרדס ובמטעי השקד של קיבוץ עין חרוד מאוחד, באישון לילה הוא החליט לעוף לממלכת ירדן, שם המערכת ממשיכה לעקוב אחר תנועתו בציפייה דרוכה. זאת אחת הפעמים הראשונות שציפור שיר יציבה תועדה כשהיא עפה קילומטרים רבים וחוצה גבול בינלאומי בישראל.

מחפש ריגושים בלילות. שחרור זכר

מחקר
מחקר חדש חושף את הבסיס הביולוגי של האמפתיה

האם יונקים, וחולדות בפרט, מסוגלים לגלות אמפתיה אחד לשני, לנקוט בהתנהגות פרו-חברתית ולסייע לאחרים במצוקה? ד"ר ענבל בן-עמי ברטל מבית הספר לפסיכולוגיה ומבית הספר סגול למדעי המוח, ערכה סדרת מחקרים בנושא והגיעה לגילויים מפתיעים. למשל, שחולדות מפעילות את מערכת התגמול במוח בזמן שהן פועלות לעזרת חברה לכודה, אבל כשמדובר בחולדה זרה ומזן אחר - אותה מערכת לא עובדת, והחולדה נותרת ללא סיוע.
במחקר הראשון בסדרת המחקרים, מבחן התנהגות עוזרת בחולדות, שפיתחה ד"ר בן-עמי ברטל במהלך הדוקטורט שלה באוניברסיטת שיקאגו עם פרופ' פגי מייסון ופרופ' ג'אן דסטי, נבדקה הנכונות של חולדה לחלץ חברה במצוקה. במבחן זה, חולדה אחת לכודה במלכודת ואחרת יכולה לשחרר אותה על ידי פתיחת דלת המלכודת מבחוץ. כשחולדות לומדות לפתוח את המלכודת הן ממשיכות לעשות זאת במהירות ובעקביות בימים הבאים, גם אם אין מגע בין החולדות לאחר העזרה.
"גילינו שלעזור לחולדה השנייה מתגמל כמו לאכול שוקולד, אם לא יותר", מספרת ד"ר בן-עמי ברטל. "המחקר התפרסם בעיתון Science וקיבל חשיפה עצומה, לאור הטענה שהחולדות מונעות על ידי אמפתיה לחולדה הלכודה. כלומר, החולדה מגיבה למצוקה של החולדה הלכודה והיא רוצה לעזור לה כדי להסיר את גורם המצוקה. במחקרי המשך נמצא שהחולדות מראות עליה ברמת הלחץ בזמן המטלה, גם אצל החולדה הלכודה וגם החופשיה, ועזרה מורידה את הלחץ לשתיהן. עוד נמצא כי מתן חומרים נוגדי-חרדה מוריד את ההסתברות שהחולדות יעזרו, אולי כי הן לא חשות את המצוקה של החולדה הלכודה".
מאז יצאו עשרות מאמרים על אמפתיה בעכברים וחולדות, והיום יש הרבה יותר קבלה של הרעיון שחיות, במיוחד יונקים חברתיים, מרגישות ומשקפות את המצוקה של אחרים. הייחוד של המודל הזה הוא שהחולדות לא רק 'נדבקות' במצוקה של האחר, אלא גם מנסות, ולרוב מצליחות, לסייע לחולדה הלכודה להשתחרר.
"אבל אז נוסף 'טוויסט' לעלילה וגילינו שכמו אצל בני אדם, חולדות לא נחמדות סתם לכל אחד. במחקר עוקב נוסף שהתפרסם ב-eLife בשנת 2014, הראינו שחולדות מראות הטיה חברתית בהתנהגות פרו-חברתית, כלומר עוזרות לבני קבוצת השייכות שלהן ולא לחולדות מקבוצות אחרות, מזן אחר בעל פרווה שחורה. הסלקטיביות הזו של התנהגות פרו-חברתית אצל החולדות מזכירה מאד את ההטיה החברתית שרואים בבני-אדם, שנוטים לחוש אמפתיה ולעזור לבני קבוצת השייכות שלהם יותר מלקבוצות אחרות. בנימה מעודדת, מגורים משותפים של שבועיים עם חולדה מהזן השני גרמה לשינוי גורף במוטיבציה הפרו-חברתית, וחיות עזרו לא רק לבת זוגן לכלוב אלא אף לחיות זרות מהזן השני, לאחר היכרות עם חולדה אחרת", מסבירה ד"ר בן-עמי ברטל.

חברות הכי טובות. ההתנהגות הפרו-חברתית אצל חולדות מזכירה את זו שקיימת אצל בני אדם
הבדל התנהגותי זה העלה את השאלה מה שונה במוח של חולדות 'אמפתיות' לעומת חולדות שלא עוזרות. במחקר החדש, בדקה ד"ר בן-עמי ברטל את הבסיס המולקולרי של ההתנהגות הזו, בתוך התמקדות בפעילות המוחית בשני התנאים האלה.
ראשית, היא סימנה בעזרת סימון זרחני של נוירונים שהיו פעילים בזמן המטלה נוירונים, שהיו פעילים בזמן שחולדות היו בנוכחות חולדה לכודה מקבוצת השייכות שלהן, או מהזן השני, ונעשה ניתוח סטטיסטי וגרפי של הרשתות המוחיות הפועלות בכל תנאי. כמו כן, נעשו הקלטות של פעילות מוחית על ידי אות סידן שמשתחרר כשנוירונים פעילים.
בשתי הקבוצות, גם בקבוצה שלא עזרה, הופעלה מערכת מוחית שקשורה לעיבוד מצוקה של אחרים, כולל אזורי מוח דומים לאלו שפועלים בשעה שבני אדם חשים אמפתיה. אבל רק בחולדות שראו חולדה מהזן שלהן נצפתה התנהגות עוזרת והפעלה של מערכת התגמול, זוהי הרשת המוחית שמעוררת מוטיבציה לבצע דברים חשובים שתורמים להישרדות, כמו אוכל או בני זוג, בכך שהיא גורמת להם להרגיש טוב.
"מחקר זה מראה שלמערכת התגמול תפקיד חשוב בהתנהגות עוזרת, ואם אנחנו רוצים להגביר את ההסתברות להתנהגות פרו-חברתית - יש לתגבר תחושת שייכות יותר מאשר אמפתיה. מחקר נוסף שנערך אצלנו עכשיו מנסה לבדוק מה קורה במוח של חולדות מהקבוצות השונות בשבועיים שהן גרות יחד ונהיות חברות, ואיך אפשר באמצעות גירוי מלאכותי של המוח לגרום לחולדות להיות אמפתיות למצוקה של חולדות מהזן השני", מסכמת ד"ר בן-עמי ברטל.

מחקר
חוקרות וחוקרים מכל העולם ממליצים פה אחד: לשלב מזונות מן המים במערכות המזון

דו"ח בינלאומי ראשון מסוגו, שחובר על ידי למעלה מ-100 מדענים מובילים מ-25 אוניברסיטאות ומכוני מחקר כמו אוניברסיטאות סטנפורד, סטוקהולם ותל אביב, בחן את תרומתם הגדולה של מזונות מן המים לתזונה, למחיה ולמערכות אקולוגיות, ושילובם בתוך מערכת המזון העולמית. תוצאות הדו"ח החדש, שהופק ביוזמת הארגון Blue Food Assessment, התפרסמו בחמישה מאמרים שונים בכתב העת היוקרתי Nature. בשני הפרסומים הראשונים מתוך החמישה, ד״ר אלון שפון מבית הספר ללימודי הסביבה ע"ש פורטר באוניברסיטת תל אביב ויו"ר הפורום הישראלי לתזונה בת קיימא, היה בין החוקרים המובילים של המחקר.
"הדו"ח החדש הוא אוסף של מחקרים שהצטברו יחד לתובנות גלובליות ומרחיקות ראות, שיוצגו באירוע ההשקה של ה-Blue Food Assessment", מסביר ד"ר אלון שפון. "עד כה, מזונות מן המים נעדרו כמעט תמיד מהשיח סביב מערכות מזון בנות קיימא. הדו"ח מוצא כי 'מזון כחול', כלומר מזון ממקורות מימיים כגון אצות, פירות ים ודגים, יכול להוביל לתרומה בריאותית חשובה עם מחיר סביבתי מופחת לעומת מזונות אחרים מהחי".
"תזונה לקויה היא אחד הגורמים המובילים לתחלואה ולתמותה בעולם,״ אומר ד"ר שפון. "למזונות מן המים יש הרבה מה לתרום מבחינה בריאותית וסביבתית בקרב מדינות עניות ואוכלוסיות מוחלשות, וגם בקרב מדינות מפותחות כגון ישראל. מזונות מן המים עשירים במגוון גדול של רכיבי תזונה כמו ויטמינים, מינרלים, חומצת שומן אומגה 3 ועוד, בהשוואה למקורות חלבון יבשתיים מן החי. בנוסף המחיר הסביבתי של מזונות מן המים, בעיקר של אצות, צדפות וסרדינים, נמוך יותר אפילו מזה של בשר עוף – ובטח ובטח נמוך יותר מהמחיר הסביבתי של גידול בשר בקר".
הדו"ח מוצא כי במדינות עניות ואוכלוסיות מוחלשות, תוספת קטנה של מזונות מן הים, כמו אצות, רכיכות ודגים, יכולה לתרום תרומה משמעותית לביטחון התזונתי ולבריאות האוכלוסייה, ובמדינות מפותחות כגון ישראל, שבה צריכת הבשר (עוף ובקר) היא מהגבוהות בעולם, החלפה של חלבון מהחי במזונות מן המים גם תשפר משמעותית את בריאות האדם, וגם תפחית את ההשפעה הסביבתית. "מצאנו שתוספת גלובלית צנועה של 8% בתצרוכת מזונות מהמים מעבר לבסיס הייצור בשנת 2030, תוביל לצמצום החוסרים התזונתיים של 166 מליוני בני אדם ברחבי העולם – וגם תפחית את המחיר סביבתי של צריכת חלבונים יבשתיים מהחי," מוסיף ד"ר שפון.
"עד כה היו מעט מאוד הערכות, רובן חלקיות, באשר להשפעה הסביבתית של גידול מזון מן הים, ולא היה ניתוח כולל שהשווה בין כל סוגי המזונות הללו בצורה אחידה", מסכם ד"ר שפון. "אנחנו סיפקנו לראשונה תמונה כוללת של ההשפעה הסביבתית של הגידול של כשלושה רבעים מסך כל המזונות הללו, וראינו שהמחיר הסביבתי של גידול אצות וצדפות הוא הנמוך ביותר בקרב כל המזונות מן המים, וזה מצטרף לתובנה כי מזונות מן הצומח – גם ביבשה – הם בעלי ההשפעה הסביבתית הנמוכה ביותר. גם מדינת ישראל צריכה לבנות חזון של מזונות מן המים ולהתבסס על הידע האדיר שקיים פה לטובת האדם והסביבה. כמדינה על ספר המדבר, מקורות המים המתוקים שלנו מצומצמים, ולכן החקלאות הימית צריכה להתמקד בים. צריך למנף את הידע והמחקר האדיר שנעשים פה בתחום של אצות ולפתח חקלאות ימית מבוססת מן הצומח, כי הם מזונות עם האימפקט הסביבתי הנמוך ביותר ועשירות מבחינה תזונתית, ורצוי שיהוו תחליף לצריכה המקומית הגבוהה של מזונות מהחי".

מחקר
מחקר חדש חושף: הסיבות האבולוציוניות לכך שלנשים קר יותר מגברים

חוקרים בבית הספר לזואולוגיה של אוניברסיטת תל אביב מציעים הסבר אבולוציוני חדש לתופעה הידועה שבה נשים מביאות סוודר לעבודה, בעוד שעמיתיהן הגברים חשים בנוח בגופייה בחלל הממוזג. החוקרים קובעים כי התופעה אינה ייחודית לבני אדם, ואם נרחיב את נקודת מבטנו, נמצא כי במינים רבים של עופות ויונקים הזכרים מעדיפים טמפרטורה קרירה יותר מהנקבות. החוקרים גורסים כי "זכרים ונקבות חשים טמפרטורה בצורה שונה. מדובר בהבדל אבולוציוני מובנה בין מערכות חישת החום של שני המינים, שקשור בין השאר לתהליכי הרבייה והטיפול בצאצאים."
המחקר נערך בהובלת ד"ר ערן לוין וד"ר טלי מגורי כהן מבית הספר לזואולוגיה וממוזיאון הטבע ע"ש שטיינהרדט באוניברסיטת תל אביב, יוסף קיאט מאוניברסיטת חיפה וד"ר חגי שרון – מומחה לכאב מהפקולטה לרפואה באוניברסיטת תל אביב ומבית החולים איכילוב. המאמר פורסם בכתב העת Global Ecology and Biogeography.
המחקר החדש כלל ניתוח סטטיסטי ומרחבי מעמיק על תפוצתם של עשרות מיני ציפורים ועטלפים החיים בישראל, לצד סקירה מקיפה של ספרות המחקר הבינלאומית בנושא. ד"ר לוין, שחוקר בין השאר פיסיולוגיה והתנהגות של עטלפים, הבחין במחקריו הקודמים כי בעונת ההמלטה נוהגים הזכרים והנקבות להיפרד, כאשר הזכרים מאכלסים אזורים קרירים יותר. כך לדוגמה, מושבות שלמות במערות במורדות החרמון מורכבות בעונה זו מזכרים בלבד, בעוד שבאזור הכנרת החם יותר נותרות בעיקר נקבות שממליטות ומגדלות שם את הגורים. התופעה עוררה את סקרנותו.
בנוסף, עיון נרחב בספרות המחקרית העלה כי תופעה דומה נצפתה במינים רבים של עופות ויונקים, ויש לכך דוגמאות רבות: במיני ציפורים נודדות, הזכרים שוהים בחורף באזורים קרים יותר מהנקבות (חשוב לציין כי אצל העופות מתרחשת ההפרדה בין המינים דווקא מחוץ לעונת הרבייה, שכן אצלם הזכרים משתתפים בגידול הגוזלים); ביונקים רבים, גם במינים שחיים בזוגות או בלהקות מעורבות כל חייהם – הזכרים יעדיפו צל בעוד הנקבות מתחממות באור השמש או שהזכרים יעלו לפסגות הרים ואילו הנקבות ישארו בעמקים.
בהמשך לסקירת הספרות, ביצעו החוקרים מחקר משלהם. הם דגמו מידע שנאסף בישראל במשך קרוב ל-40 שנה (2018-1981) על אלפי פרטים של 13 מיני ציפורים נודדות מ-76 אתרים (נתונים של מרכז הטיבוע הישראלי ומוזיאון הטבע ע"ש שטיינהרדט), ו-18 מיני עטלפים מ-53 אתרים (נתונים של החוקרים ושל החברה להגנת הטבע). בסך הכול כלל המחקר למעלה מ-11,000 פרטים, מהחרמון בצפון ועד אילת בדרום.
הסיבה לבחירה בציפורים ובעטלפים היא העובדה שהם מעופפים ולכן ניידים מאוד, והחוקרים שיערו שההפרדה המרחבית בין הזוויגים - לעיתים עד כדי שהייה באזורי אקלים שונים, תהיה ברורה במיוחד בקבוצות אלה. יתרה מכך, המגוון האקלימי הגדול של ישראל איפשר להם לבחון פרטים מאותו מין שחיים בתנאי אקלים שונים מאוד. ממצאי המחקר הראו בבירור כי הזכרים מעדיפים טמפרטורה נמוכה יותר מהנקבות, והעדפה זו יוצרת הפרדה בין המינים בתקופות מסוימות במחזורי הרבייה, כשהזכרים והנקבות אינם זקוקים זה לזה, ואף עלולים להפריע.
"המחקר שלנו הוכיח שהתופעה אינה ייחודית לאדם," אומר ד"ר לוין, "גם בקרב מינים רבים של עופות ויונקים, הנקבות מעדיפות סביבה חמימה יותר מהזכרים, ובתקופות מסוימות העדפות אלה גורמות להפרדה בין שני המינים. לאור הממצאים, והעובדה כי מדובר בתופעה נרחבת, העלינו השערה כי מדובר בשוני בין מנגנוני חישת החום של נקבות וזכרים, שהתפתח במהלך האבולוציה. שוני זה דומה במהותו להבדלים מוכרים בין תחושות הכאב של שני הזוויגים, והוא מושפע מהבדלים במנגנונים עצביים האחראים לתחושה וגם מהבדל הורמונלי בין זכרים לנקבות.
ד"ר מגורי כהן מציינת כי לשוני יש מספר הסברים אבולוציוניים: ראשית, ההפרדה בין זכרים לנקבות מפחיתה את התחרות על המשאבים בסביבה, ומרחיקה מהנקבות זכרים שעלולים להיות תוקפניים ולסכן את הגורים. ובנוסף, נקבות של יונקים רבים נדרשות להגן על הוולדות בשלב שבו הם אינם מסוגלים עדיין לווסת את חום גופם בעצמם, ולכן התפתחה בהן ההעדפה למקום חם יחסית.
ד"ר לוין וד"ר מגורי כהן מסכמים: "בשורה התחתונה, אם נחזור לעולמם של בני האדם, ניתן לומר שההבדל בתחושת הטמפרטורה לא נועד כדי שנריב עם בנות/בני זוגנו על המזגן, אלא להפך: הוא נועד לגרום לבני הזוג לתפוס קצת מרחק זה מזה לפעמים, כך שלשני הצדדים יהיה נעים ושקט יותר. כמו כן ניתן לקשר את התופעה לתופעות סוציולוגית הנצפות בבעלי חיים רבים ואף באדם, בסביבה מעורבת של נקבות וזכרים: הנקבות נוטות ליצור מגע רב ביניהן, ואילו הזכרים מרוחקים יותר ונרתעים ממגע."

מחקר
מי הם התאים שנלחמים בגידול הסרטני ואחר כך מגויסים לתמוך בהתפתחותו?

גליובלסטומה היא הסוג הנפוץ ביותר של סרטן המוח, אחד מהסרטנים האלימים והקטלניים בבני אדם: תוחלת החיים הממוצעת של החולים בה היא כשנה עד כשנה ושלושה חודשים מרגע הגילוי. לרוב, המעקב המדעי אחר התפתחות הגידול הסרטני בקרב חיות מודל נעשה ללא מערכת חיסון פעילה, בכדי לאפשר את קליטת תאי הסרטן בגוף ואת התפתחותם. החיסרון במודל נפוץ זה הוא בכך שמערכת החיסון אינה קיימת או אינה מתפקדת כראוי, מה שמונע מהחוקרים לעקוב אחר האינטראקציה בינה ובין תאי הגידול.
מחקר חדש של אוניברסיטת תל אביב בחן לראשונה את התפתחות הגידול הסרטני גליובלסטומה בקרב חיות מודל בעלי מערכת חיסונית תקינה, במטרה לדמות בצורה הטובה ביותר את התפתחות הגידול בבני אדם. בצורה כזו הסרטן מתפתח בצורה מדורגת עד להתפתחות גידול מאסיבי, מה שמאפשר מעקב צמוד אחר התפתחותו ולכל אורך הדרך ניתן לעקוב אחר האינטראקציה של תאי הסרטן עם תאים שונים של מערכת החיסון. ממצאי המחקר הראו שישנם תאים במערכת החיסון שעל אף שתפקידם המקורי הוא לתקוף את התאים הסרטניים ולחסלם, הם פועלים "כסוכנים כפולים" שמגבירים ומעצימים את האגרסיביות והמסוכנות של הגידול.
המחקר נערך בהובלתה של ד״ר דינורה פרידמן-מורבינסקי ופררנה מגוד מהפקולטה למדעי החיים ע"ש ג'ורג' ס' וייז. לצדם, ד״ר ליאת רוסו-נורי ואיגנסיו מסטנדריאה, אף הם מהפקולטה למדעי החיים, וכן חוקרים נוספים מהפקולטה לרפואה ע״ש סאקלר באוניברסיטת תל אביב וממכון ויצמן למדע. המחקר פורסם בכתב העת היוקרתי Cell Reports.
במסגרת המחקר, גילו החוקרים כי לתאים הנקראים נויטרופילים תפקיד קריטי באינטראקציה עם הגידול הסרטני. נויטרופילים הם תאים במערכת החיסון, שמקורם במוח העצם, ומטרתם לבלוע או לחסל חיידקים ופטריות ולטהר את הזיהומים שנגרמו מהם. "הנויטרופילים הם החיילים הראשונים במערך הקרב של מערכת החיסון", אומרת ד"ר פרידמן-מורבינסקי. "כאשר הגידול מתחיל להתפתח, הנויטרופילים הם בין הראשונים שמגויסים לכיוונו ותוקפים אותו על מנת לחסלו״.
יתר על כן, לחוקרים התברר כי הנויטרופילים נמצאים בקרבת הגידול לכל אורך ההתפתחות שלו, וישנו גיוס מתמשך ועקבי שלהם ממוח העצם. הדבר המפתיע שהתגלה במהלך מחקר זה, הוא כי הנויטרופילים משנים את תפקידם: אם בתחילת הדרך, בעת הופעת הגידול הראשוני, הנויטרופילים הגיעו על מנת להילחם בגידול, הרי שעם הזמן הנויטרופילים המגויסים לאזור הסרטני מגיעים על מנת לתמוך בהתפתחותו. לדברי ד"ר פרידמן-מורבינסקי: "הנויטרופילים מגויסים תחילה ע"י הגידול עצמו והופכים מאנטי-סרטניים לפרו-סרטניים, וכתוצאה מכך הם מחמירים את הנזק שהגידול עצמו יוצר". בנוסף החוקרים גילו כי תהליך השינוי בתכונות של הנויטרופילים יכול להתבצע ב"שלט רחוק", עוד לפני שהם בכלל מתקדמים לכיוון הגידול עצמו.
"המחקר הראה כי השינוי בתכונות של הנויטרופילים מתרחש עוד במוח העצם עצמו – בו כלל אין גידול: הגידול הסרטני ממוקם רק במוח ומשם מצליח לשנות את תכונות התאים אותם הוא מגייס", מוסיפה ד"ר פרידמן-מורבינסקי. "הגילויים החדשים במחקר זה עשויים לשפוך אור גם על דרכי הטיפול האימונותרפיות, אשר צוברות תאוצה רבה בשנים האחרונות. באחד מסוגי הטיפול האימונותרפי, מוציאים מגוף החולה תאי T, מעבדים אותם ומחזירים אותם לגוף החולה כך שהחדירו להם יכולות ריפוי מוגברות. אחת הבעיות המרכזיות היום הוא העובדה שגם תאים אלו שנשלחו לריפוי עוברים דיכויי ופעולתם מושתקת. אם נדע כיצד לשנות את יחסי הגומלין בין הנויטרופילים לתאי ה-T כך שהדיכוי שלהם יופחת, לדבר יהיו השלכות על יעילות הטיפול האימונותרפי".
לא מן הנמנע כי גילויים אלה הם הצעד הראשון לקראת פיצוח מנגנון ההשפעה ההדדית בין מערכת החיסון ובין גידולים סרטניים אלימים שגובים, כאמור, את חייהם של רבים כל כך.

מחקר
לא רק היריון זכרי. סוסוני הים מפליאים ומצטיינים גם ביכולת הטרף שלהם

סוסוני הים נחשבים לשחיינים גרועים במיוחד, אך למרות האיטיות היחסית הם מצליחים לטרוף דגים קטנים וזריזים. במחקר חדש של אוניברסיטת תל אביב, החוקרים הצליחו לראשונה לאפיין את יכולת הטרף המופלאה של סוסוני ים ומצאו כי הם מסוגלים להניע את הראש מלמטה למעלה במהירות אדירה של 2 אלפיות לשנייה. הנעת הראש המהירה מלווה בזרם חזק של מים ששואב את הדגים הקטנים ישירות לתוך הלוע של הסוסונים.
המחקר נערך בהובלת פרופ' רועי הולצמן ותלמידת המחקר קורין ג'קובס מבית הספר לזואולוגיה בפקולטה למדעי החיים ע"ש ג'ורג' ס.וייז ומוזיאון הטבע ע"ש שטיינהרט באוניברסיטת תל אביב. המחקר פורסם בכתב העת Journal of Experimental Biology.
החוקרים מסבירים שסוסוני ים הם דגים הניחנים בשלל תכונות ייחודיות כמו 'הריון' זכרי, חוליות עמוד שדרה מרובעות וכמובן מנגנון האכילה הייחודי: במשך מרבית שעות היום הסוסונים שוחים בים כאשר ראשם מוטה כלפי מטה וקרוב לגוף. אך כאשר הם מבחינים בטרף שעובר מעליהם, הם מרימים את הראש במהירות אדירה ותופסים אותו. לדבריו של פרופ' הולצמן, בעת ביצוע הטרף, סוסוני הים הופכים את גופם למעין קפיץ: הם מותחים גיד אלסטי באמצעות שרירי הגב ומשתמשים בעצמות הצוואר כ'הדק', ממש כמו רובה קשת. התוצאה מהירה יותר מהתכווצות השריר המהירה ביותר בכל מקום בעולם החי.
אלא שעד כה לא היה ברור למדע כיצד המנגנון הקפיצי מאפשר לסוסונים לאכול בפועל. כמו שיודע כל מי שניסה אי פעם לשלות זבוב מכוס תה, מים הם תווך צמיגי, והדג צריך לפתוח את הפה כדי לייצר זרם ששואב את הטרף פנימה. אבל איך הסוסונים מתאמים בין שאיבת הטרף לתנועת הראש?
במחקרם החדש, החוקרים מאוניברסיטת תל אביב הצליחו לאפיין ולכמת את תנועת סוסוני הים על ידי צילום תקיפתם במהירות של 4,000 תמונות לשנייה ומערכת לייזר לדימות הזרמים במים. מדידה זו הראתה כי מערכת "רובה הקשת" משרתת שתי מטרות: הנעת הראש ויצירת זרמי שאיבה מהירים ביותר, פי 10 מדגים בגודל דומה – מה שמאפשר לסוסוני הים לתפוס פרטי טרף חמקניים במיוחד.
המדידות החדשות עוזרות גם לשפוך אור על המורפולוגיה של סוסוני הים השונים, הנבדלים אלה מאלה באורך החוטם. "המחקר שלנו מראה שאורך האף של הסוסונים קובע את מהירות הנעת הראש ואת מהירות זרמי השאיבה", מוסיף פרופ' הולצמן. "אבולוציונית, הסוסונים צריכים לבחור – אף קטן לזרמי שאיבה חזקים והעלאת ראש מתונה או אף ארוך להעלאת ראש מהירה ולזרמי שאיבה חלשים. הבחירה הזאת מסתדרת כמובן עם הדיאטה הזמינה: מינים עם חרטום ארוך תופסים חיות קטנות וזריזות יותר ומינים עם חרטום קצר תופסים חיות כבדות ומגושמות יותר".
לדברי פרופ' הולצמן, סוסוני ים אינם מקרה פרטי של המנגנון הקפיצי המרשים. למעשה, סוסוני הים נמנים עם משפחת דגים בשם המדעי ההולם Misfit Fish ("דגים חריגים"), הכוללת מינים כמו אבובונים, שח-ראשים וחלילינים.
"הדגים האלה נקראים ככה בגלל הצורה המוזרה שלהם, שמאפשרת את מתיחת הגוף לקפיץ. השאלה הגדולה היא מהי האבולוציה של המנגנון הקפיצי – איך היא נוצרה ומתי היא התפתחה. אני מקווה שהמחקר החדש שלנו יוביל למחקרים נוספים, שיעזרו לפתור את חידת הדגים הקפיציים".

מחקר
חוקרים מצאו שניתן לנצל את תכונות ההרס השליליות של תאי דם לבנים מסוג אאוזינופילים גם לטובת פגיעה והרס של גידולים סרטניים

אאוזינופילים הם תאי דם לבנים של מערכת החיסון, המפרישים חלבונים בעלי עוצמה הרסנית, שתפקידם באבולוציה הוא להילחם בטפילים. עם זאת, בעולם המערבי המודרני, כשהטפילים הולכים ומתמעטים בשל הקפדה על רמת היגיינה גבוהה, הופכים האאוזינופילים תכופות לגורם שלילי, שמחולל אלרגיות ואסתמה. מחקר חדש שנערך באוניברסיטת תל אביב מצא שהאאוזינופילים מגויסים למלחמה בגרורות סרטניות בריאות. על פי המחקר, תאי הדם הלבנים מפרישים חלבונים הרסניים ובו זמנית מגייסים תאי T של מערכת החיסון, למלחמה משותפת בגידולים הסרטניים. ממצאי המחקר עשויים לתרום לפיתוח גישות חדשניות לטיפול אימונותרפי בסרטן, המתבססות על שיתוף הפעולה בין תאי T לאאוזינופילים.
לדברי החוקרים, יכולתם של האאוזינופילים לזרוע הרס עשויה להפוך לגורם חיובי, שמחסל את התאים הסרטניים. "בחרנו להתמקד בגרורות ריאתיות משתי סיבות עיקריות: ראשית, אחת הבעיות המרכזיות במלחמה בסרטן הן הגרורות ולאו דווקא הגידול הראשוני, והריאות הן יעד עיקרי לגרורות של סוגי סרטן רבים. שנית, במחקר מקדים הראינו כי אאוזינופילים מגיעים לגידולים סרטניים שמתפתחים ברקמות ריריות כמו הריאות, ולכן סברנו שהם יגיעו גם לגרורות ריאתיות", מסביר פרופ' אריאל מוניץ, שהוביל את המחקר ביחד עם הדוקטורנטית שרון גריסרו, מהמחלקה למיקרוביולוגיה ואימונולוגיה קלינית בבית הספר לרפואה ע"ש סאקלר.
בשלב הראשון בחן המחקר רקמות סרטן אנושיות באמצעות ביופסיות של גרורות ריאתיות, שנלקחו מחולות בסרטן השד גרורתי. החוקרים מצאו כי האאוזינופילים אכן מגיעים לריאות, חודרים לרקמות הסרטניות, ומשחררים בהן את חומרי ההרס שהם נושאים. כדי לבחון את תפקידם של אאוזינופילים בגרורות, החוקרים נעזרו במודל חיות ומצאו כי גרורות ריאתיות שהתפתחו ללא אאוזינופילים היו גדולות בהרבה מאשר אלו שהותקפו על ידי אאוזינופילים. ממצאים אלה הובילו למסקנה כי האאוזינופילים נלחמים ביעילות כנגד הסרטן, אך עדיין נותרה השאלה: כיצד הם עושים זאת?
"במהלך המחקר הבחנו כי כשאין ברקמה אאוזינופילים - נעדרים ממנה גם תאי T, שהם תאי דם לבנים שידוע כי הם נלחמים בסרטן. מכאן הנחנו שהאאוזינופילים פועלים כנגד הגידול הסרטני באמצעות תאי T, וביקשנו להבין את המנגנון המאפשר זאת", מסביר פרופ' מוניץ.
לשם כך ביצעו החוקרים אנליזה נרחבת לאפיון האאוזינופילים המצויים בגרורות, והעלו שני ממצאים משמעותיים: ראשית, אאוזינופילים שנמצאים בסביבה סרטנית משחררים כמות גדולה של חומרים המכונים כימוקינים, המזמנים את תאי ה-T, ושנית, הכימוקינים משתחררים בתגובה לשני חומרים אחרים שנמצאים בסביבת הסרטן: IFN-g וTNF-a. כלומר, אאוזינופילים שנחשפו ל-IFNg ול-TNFa מגייסים תאי T. בשלב האחרון של המחקר החוקרים זיהו שהדבר גורם להתפתחות של תאי T בריאות הגרורתיות ולהאטה בהתפתחות הגידולים הסרטניים. המחקר פורסם ב-Cancer Research, כתב עת יוקרתי של האגודה האמריקאית לחקר הסרטן.
"הגדלת מספרם ועוצמתם של תאי T היא אחת המטרות המרכזיות של טיפולי אימונותרפיה הניתנים היום לחולי סרטן. אנחנו גילינו אינטראקציה חדשה שמגייסת מספר רב של תאי T לרקמות סרטניות, ולממצאים אלה עשויות להיות השלכות טיפוליות", מסביר פרופ' מוניץ ומסכם "המחקר שלנו עשוי להוות בסיס לפיתוח תרופות אימונותרפיות משופרות, הנעזרות באאוזינופילים למיגור הסרטן. מצד אחד, האאוזינופילים ישחררו את חלבוני ההרס שלהם כנגד הסרטן, ומצד שני הם יגדילו את מספר תאי ה-T בסביבה הסרטנית. אנו משערים כי ההשפעה המשולבת תוכל להגביר משמעותית את יעילות הטיפול."
המחקר מומן על ידי ICRF (הקרן הישראלית לחקר הסרטן), האגודה למלחמה בסרטן, ISF (הקרן הלאומית למדע), BSF (קרן הדו-לאומית למדע של ארה"ב וישראל), וחברת GSK.
מחקר
המחקר סולל דרך לטיפול מניעתי בעתיד כנגד אלצהיימר ודמנציה, לפני ניוונן של רקמות מוח רבות והופעתם של תסמינים קליניים

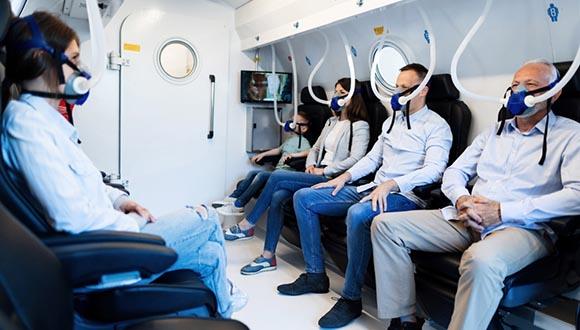
רפואה היפרברית היא צורת טיפול שבמסגרתה המטופלים שוהים בתאים מיוחדים, שבהם הלחץ האטמוספרי גבוה בהרבה מהלחץ שאנו חווים בגובה פני הים, ובנוסף נושמים אוויר המורכב מ-100% חמצן. רפואה היפרברית נחשבת לבטוחה, והיא כבר משמשת לטיפול בשורה ארוכה של מצבים רפואיים – לרבות כאן בישראל. בשנים האחרונות מצטברות ראיות מדעיות לכך שפרוטוקולים יחודיים של טיפולים היפרבריים יכולים לשפר את אספקת החמצן למוח ולעודד את ייצורם של כלי דם ותאי עצב חדשים.
לאחרונה, הצליח צוות חוקרים מאוניברסיטת תל אביב לשקם פגיעה מוחית על ידי טיפול היפרברי (תא חמצן). זאת הפעם הראשונה במדע העולמי שטיפול לא-תרופתי מוכח כיעיל במניעת התהליכים המובילים להתפתחות של מחלת האלצהיימר. המחקר שילב סדרת טיפולים בתא לחץ של קבוצת נסיינים מעל גיל 65 לצד ממצאי מעבדה שנלקחו ממודל חיות.
המחקר נערך בהובלת צוות החוקרים מאוניברסיטת תל אביב: פרופ' שי אפרתי, פרופ' אורי אשרי, ד"ר רונית שפירא, ד"ר פבלו בלינדר וד״ר אמיר הדני, כולם מבית הספר סגול למדעי המוח ומהפקולטות למדעי החיים ולרפואה באוניברסיטת תל אביב וכן מהמרכז הרפואי שמיר. תוצאות המחקר פורץ הדרך מתפרסמות היום בכתב העת היוקרתי Aging.
השלב הראשון במחקר נערך במודל חיות ובמסגרתו הוכיחו באופן ישיר בבדיקת רקמת המוח כי פרוטוקול טיפולי מסוים מביא לשיפור תפקוד כלי הדם, יצירת כלי דם חדשים, מונע את שקיעתם של פלאקים עמילואידיים חדשים על תאי העצב ואף מוביל להסרת פלאקים עמילואידיים קיימים. עמילואידים הם חלבונים בלתי-מסיסים, ששקיעתם במוח מקושרת למחלות ניווניות קשות כמו אלצהיימר.
בשלב הבא נבדקה השפעת הטיפול גם בבני אדם מעל לגיל 65 עם ירידה בתפקודי המוח בדגש על ירידה משמעותית בזיכרון – שלב לפני אלצהיימר ודמנציה. הטיפול כלל סדרה של 60 טיפולים בתאי לחץ, לאורך תקופה של 90 יום, והערכת ההשפעה המוחית נעשתה באמצעות MRI ברזולוציה גבוהה. פרוטוקול הטיפול ההיפרברי הוביל לזרימה משופרת ב-16% עד 23% של דם למוח, לשיפור בזיכרון של 16.5% בממוצע, לשיפור בקשב ובריכוז של 6% בממוצע ולשיפור ממוצע במהירות עיבוד המידע של 10.3%.
"על ידי לימוד וטיפול בסימפטומים של מחלת האלצהיימר בחיות מודל, נוכל ליישם את ההבנות שלנו גם בבני אדם", מסביר פרופ' אורי אשרי. "לאחר סדרת טיפולים היפרבריים, מבוגרים שכבר סבלו מאובדן זיכרון הראו שיפור בזרימת הדם במוח – וכן שיפור ממשי בביצועים קוגניטיביים. בכך הצלחנו להדגים את הפוטנציאל הטמון ברפואה היפרברית לטיפול במצבים נוירולוגיים שמקורם בהיפוקסיה, כלומר במחסור בחמצן שמגיע לתאים".
"פריצת הדרך התאפשרה הודות לגישה מחקרית חדשה העושה שימוש במיקרוסקופים מולטי-פוטוניים", אומר ד"ר פבלו בלינדר. "זה אפשר לנו לעקוב אחר שיפורים במדדים של חיות המודל במעבדה לפני ואחרי כל טיפול בתא, ובד-בבד לעקוב אחר קוטר כלי הדם והיווצרות הפלאקים העמילואידיים במוחם".
"השילוב של חיות מודל שאפשר ללמוד מהן על הפתולוגיה של המחלה, יחד עם טיפול קיים וזמין, מעורר תקווה לגבי היכולת שלנו להילחם באחד האתגרים הגדולים ביותר של העולם המערבי", מוסיפה ד"ר רונית שפירא. "לפי התוצאות שלנו, טיפולים היפרבריים בגיל צעיר עשויים למנוע כליל את המחלה הקשה".
"על ידי טיפול בבעיית השורש של ההתדרדרות הקוגניטיבית עם הגיל, אנחנו למעשה ממפים את הדרך לקראת מניעה", מסכם פרופ' אפרתי. "ייתכן שרפואה היפרברית טומנת בחובה את ההזדמנות לחיות עם תפקוד מוחי גבוה ללא קשר לגיל הכרונולוגי. הרעיון הוא להתחיל בטיפולים לפני הופעתם של תסמינים קליניים לדמנציה, עוד לפני ניוונן ואובדנן של רקמות מוח רבות, בשלב שבו נחסמים כלי דם ויורדת זרימת הדם ואספקת החמצן במוח – וזה יכול להופיע כבר בגיל צעיר יחסית".